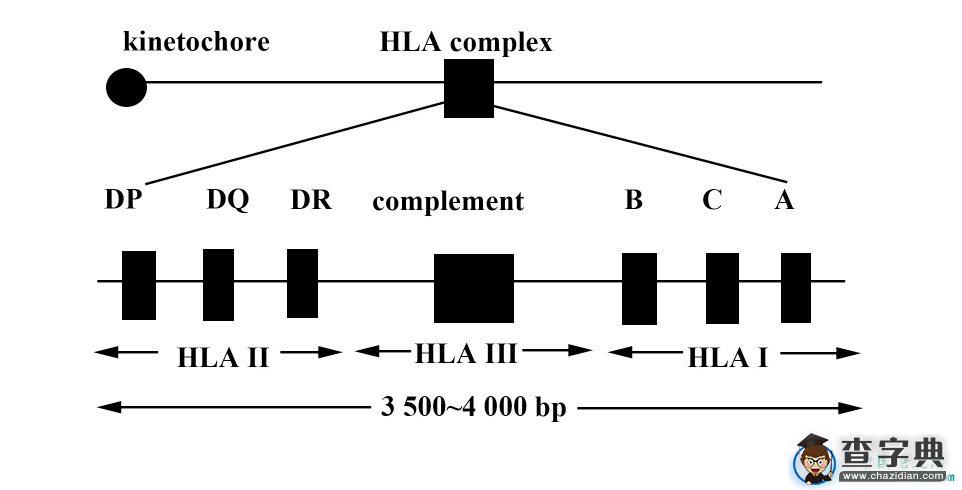
2.1 乳糜泻 (Celiac disease, CD) 与HLA的相关性
CD是携带有遗传易感基因的个体因摄入含麸质蛋白的谷物及其制品而诱发的自身免疫性肠病。欧洲人CD的发生率为1%[1]。HLA-DQ2 (DQA1*0501-DQB1*0201) 和HLA-DQ8 (DQA1*0301-DQB1*0302) 基因单倍型几乎出现于所有的乳糜泻患者, 但大部分携带有HLA-DQ2和HLA-DQ8基因单倍型的个体并不发展为乳糜泻, 意味着还有未确认的遗传因素参与了乳糜泻的发生[1]。DQA1*05:01和DQB1*02:01是最主要的风险基因[2]。Piancatelli等使用聚合酶链式反应-序列特异性引物 (Polymerase chain reaction-sequence-specific primer, PCR-SSP) 对HLA进行基因分型发现DQ2.2和DQ2.5在摩洛哥CD患者出现的频率较正常对照高, 且差异具有统计学意义, 而DQ8在摩洛哥CD患者和正常对照之间出现频率差异无统计学意义[3]。与HLA-DQ2.5/X (X指等位基因位点为非DQ2.5) 杂合子个体相比, HLA-DQ2.5纯合子个体具有更高的患CD风险, 这是由于HLA-DQ2.5表达在抗原呈递细胞表面并使其更有效地进行麸质提呈, DQB1*02纯合子对CD严重程度的影响已被证实[3]。DR3-DQ2、DR7-DQ2基因单倍型与摩洛哥人CD有关[3]。Senapati等[4]发现HLA-DQ2.2 (rs2395182等位基因T) 、HLA-DQ2.2 (rs7775228等位基因T) 、HLA-DQ2.5 (rs2187668等位基因A) 、HLA-DQ4 (rs4713586等位基因T) 、HLA-DQ8 (rs7454108等位基因T) 可以增加患CD的风险。Bibb等[5]发现乳糜泻患者更常伴发其他自身免疫病, 其中桥本甲状腺炎排在首位, 其次是1型糖尿病和牛皮癣, 这种关联可能是上述疾病有着共同的遗传易感基因位点, 比如HLA-DR3、DQ2, 并且发现CD与慢性自身免疫病的发生有关。
表1 HLA介导的常见自身免疫病及相关的HLA等位基因及单倍型Tab.1 HLA-mediated common autoimmune diseases and their associated alleles and haplotypes

2.2 系统性红斑狼疮 (Systemic lupus erythem-ato-sus, SLE) 与HLA的相关性
SLE是一种累及多系统的慢性自身免疫性疾病, 其特征在于产生抗核抗体, 导致组织炎症和器官损伤。目前已发现遗传因素与SLE的发生和发展有关, 尤其以HLA与SLE的关系最为密切。徐丹萍等[6]发现SLE患者外周血单核细胞中HLA-G分子较正常人表达量减少。Mitsdoerffer等[7]发现多发性硬化患者单核细胞膜表面表达的HLA-G分子较正常人显着降低, 另外, 1型糖尿病也有此现象。Rizzo等[8]对SLE患者和正常人对照研究发现:HLA-G第8个外显子14 bp插入 (+14 bp) 等位基因频率和纯合子插入 (14 bp+/+) 基因型频率都较正常对照显着升高, 而缺失纯合子 (14 bp-/-) 基因型频率较正常对照显着降低, 提示14 bp片段的多态性是SLE的潜在风险因素。HLA-DR3 (DRB1*03:01-DQA1*05:01-DQB1*02:01) 和DR15 (DRB1*15:01/03-DQA1*01:02-DQB1*06:01) 是SLE的风险基因单倍型, 且两者存在一定的连锁, DRB1*03:01、DQA1*04:01、DQA1*05:01、DQA1*01:02、B*08:01、B*18:01是SLE的风险基因, DRB1*01:02、DRB1*12:01、DQA1*01:04、DQB1*03:02、C*04:01是SLE的保护基因, HLA-DQB1位点rs9273448等位基因A也是SLE的一种保护性因素[9]。Fernando等[10]发现西班牙SLE患者与HLA-DRB1*03:01、DRB1*15:01、DRB1*08:01有关, 日本SLE患者与DRB1*15:01有关, 且HLA-DRB1*15基因亚型分布呈现地域差异, 在欧洲人中常见的等位基因是HLA-DRB1*15:01, 太平洋和东南亚人群常见的等位基因是HLA-DRB1*15:02, 而在非洲人群中是HLA-DRB1*15:03。Bettencourt等[11]发现DRB1*13是系统性红斑狼疮、类风湿性关节炎、系统性硬化症共同的保护基因, DRB1*03是系统性红斑狼疮、多发性硬化、重症肌无力共同的风险基因, DRB1*09是系统性红斑狼疮、多发性硬化、类风湿性关节炎共同的保护基因。
2.3 类风湿性关节炎 (Rheumatoid arthritis, RA) 与HLA的相关性
RA是一种以关节滑膜增生和软骨破坏为特征的慢性全身性自身免疫病, 遗传与HLA-DRB1关系最为密切, 与RA相关的DRB1等位基因编码的DR分子链的第3高变区第70~74位氨基酸有着QKRAA (谷氨酸-赖氨酸-精氨酸-丙氨酸-丙氨酸) 、QRRAA (谷氨酸-精氨酸-精氨酸-丙氨酸-丙氨酸) 或RRRAA (精氨酸-精氨酸-精氨酸-丙氨酸-丙氨酸) 共同序列, 其不仅增加了个体患RA的风险, 而且还使个体表现为发病呈年轻化的趋势, 更严重的骨侵蚀和产生抗瓜氨酸化蛋白抗体 (Anti-cyclic citrullinated peptide antibodies, ACPA) , 此外RA患者关节炎骨破坏的严重程度与HLA-DRB1等位基因编码的共同序列的数目呈正相关[12]。HLA-DRB1分子第11位氨基酸是亮氨酸或者缬氨酸则增加患RA的风险, 第11位氨基酸是丝氨酸则减少患RA的风险[13]。陈佳喜等[14]发现RA患者外周血s HLA-G和调节性T细胞比正常人显着降低, RA患者用甲氨蝶呤治疗后, HLA-G的表达显着升高。李长红等[15]发现RA患者与正常对照相比, HLA-G14 bp插入/缺失等位基因及基因型频率差异在两组间无统计学意义;而RA抗核小RNA蛋白 (snRNP) 抗体、抗组蛋白抗体阳性患者与抗snRNP抗体、抗组蛋白抗体阴性患者相比, HLA-G 14 bp插入/缺失多态性分布差异有统计学意义, 抗snRNP抗体阳性组+14 bp等位基因与+14 bp/-14 bp杂合子基因型频率较抗snRNP抗体阴性组显着增加, 抗组蛋白抗体阳性组-14 bp等位基因与-14 bp/-14bp纯合子基因型频率较抗组蛋白抗体阴性组显着增加。Tokunaga等[16]发现欧洲人RA相关性最强的HLA-DR4亚型是DRB1*04:01, 日本人RA相关性最强的HLA-DR4亚型是HLA-DRB1*04:05。Trier等[17]发现HLA-DRB1*04:01/04/05/08/09、DRB1*01:01/02、DRB1*10:01、DRB1*14:02是RA的风险基因。Achour等[18]应用Taqman基因分型方法发现rs6457617 (位于HLA-DQB1) TT基因型与突尼斯人RA的易感性有关, rs6457617*T-HLA-DRB1*04+单倍型明显增加突尼斯人患RA的风险, rs6457617与HLA-DRB1存在着一定的连锁, rs6457617T等位基因和TT基因型有着更高的抗环瓜氨酸抗体, 而rs13192471 (位于HLA-DRB1) 与RA的易感性和严重程度无关。
2.4 强直性脊柱炎 (Ankylosing spondylitis, AS) 与HLA的相关性
AS是一种致畸的慢性自身免疫系统疾病, 主要影响脊柱和骶髂关节, 其次还会影响外周关节和眼睛、肠道、皮肤等, 汉族人群的患病率为0.2%~0.54%, 男女患病比为 (2~3) ∶1[19]。遗传以HLA-B27关系最为密切, HLA-B27通过分子模拟机制和蛋白错误折叠参与AS的病理过程。Sheehan等[20]发现HLA-B*27:05几乎存在于所有种族中, 推断它可能是祖先型等位基因。高加索人与AS相关的主要亚型是HLA-B*27:05和HLA-B*27:02, 亚洲人与AS相关的亚型主要是HLA-B*27:04和HLA-B*27:07, 在地中海人群中是HLA-B*27:02[21]。HLA-B*60与英国HLA-B27阳性的AS患者有关[22], HLA-B*60和HLA-B*61与台湾HLA-B27阴性的AS患者有关[23], HLA-B*39与日本HLA-B27阴性的AS患者有关[24]。目前发现了除HLA-B27以外与AS相关的基因:HLA-B*51:01、HLA-B*47:01、HLA-B*40:02、HLA-B*13:02、HLA-B*40:01, 它们可以增加个体患AS的风险, HLA-B*07:02、HLA-B*57:01可以减少患AS的风险[25], 其中HLA-B*51是脊柱关节炎相关疾病的遗传风险因素, 同时也是白塞病的风险因素, 因此推断可能有着共同的发病机制[19]。进一步陆续发现了除HLA-B位点以外和AS相关的基因:比如HLA-A*02:01、HLA-DPB1、HLA-DRB[25]。姜芳等[26]发现HLA-B27表达水平与基质金属蛋白酶 (骨侵蚀重要蛋白水解酶家族) 表达水平呈正相关, 在亚洲人中主要以HLA-B*27∶04为主。代东发等[27]发现以HLA-B*27∶04与AS的关联性最强, 其次是B*27∶02、HLA-B*27∶05、B*27∶07。李苗等[28]发现HLA-B27可能会影响肠道菌群, 进而产生大量的细胞因子介导免疫细胞, 进而产生自身免疫反应。Wang等[29]发现HLA-C*12:02:02与台湾AS有关。
2.5 1型糖尿病 (Type 1 diabetes, T1D) 与HLA的相关性
T1D属于多基因遗传性疾病, 主要影响产生胰岛素的细胞并导致终身依赖于外源性胰岛素。研究报道, DRB1*03-DQA1*05-DQB1*02 (DR3-DQ2) 和DRB1*0401/2/4/5-DQA1*0301-DQB1*0302 (DR4-DQ8) 的两种HLAⅡ类DR-DQ单倍型与T1D的发生显着相关, 特别是DR3-DQ2也与多种其他自身免疫性疾病有关[30]。杨丽等[31]发现T1D患者HLA-DRB1*04频率较正常人高, 且差异具有统计学意义, HLA-DRB1*15、HLA-DRB1*16是T1D的保护基因。Reinauer等[32]发现DRB1*03:01-DQA1*05:01-DQB1*02:01 (DR3-DQ2) 、DRB1*04-DQA1*03:01-DQB1*03:02 (DR4-DQ8) 、DRB1*04:05-DQA1*03:01-DQB1*02:02、DRB1*08:01-DQ A1*04:01/02-DQB1*04:02 (DR8-DQ4) 基因单倍型与T1D有关, DRB1*07:01-DQA1*02:01-DQB1*02:02和DRB1*13:01-DQA1*01:02-DQB1*06:03是T1D的保护性基因单倍型, 它在T1D人群中出现频率较低。Fagbemi等[33]通过PCR-SSP基因分型方法发现DR3、DR3-DR4是T1D的风险基因单倍型, DQA1*05:01、DQB1*02:01是T1D的风险基因, DR3、DR3-DR4、DQA1*05:01、DQB1*02:01使得患T1D的风险增加3~14倍, DR4、DQB1*03:02、DQB1*06:02在T1D患者与正常对照组之间出现的频率差异无统计学意义。DQA1*05:01是T1D的风险基因, 同样的结论也出现在法国、巴西、西班牙T1D人群[33]。
2.6 多发性硬化 (Multiple sclerosis, MS) 与HLA的相关性
MS是一种由遗传和环境因素共同作用的多基因遗传性疾病, 临床特征以神经脱髓鞘改变为主, 且年轻女性多见。Shahbazi等[34]应用PCR-SSP基因分型方法对伊朗MS患者与健康对照组研究发现:HLA-DRB1*15与IL-10的基因多态性与MS易感性相关, 并且DRB1*15等位基因与IL-10多态性的相互作用可能在MS的易感性中起重要作用。Moutsianas等[35]应用Meta分析发现HLA-DRB1*15:01、HLA-DRB1*13:03、HLA-DRB1*03:01、HLA-DRB1*08:01、HLA-DQB1*03:02是欧洲人群MS的风险基因, HLA-A*02:01、HLA-B*44:02、HLA-B*38:01、HLA-B*55:01是欧洲人群MS的保护性基因, 在DRB1*15:01存在的情况下HLA-DQA1*01:01对欧洲人群MS有着强烈的保护作用。Nakamura等[36]对HLA-DRB1进行基因分型发现:DRB1*04:05、DRB1*15:01是日本人群MS的风险基因, DRB1*01:01、DRB1*09:01、DRB1*13:02、DRB1*15:02是日本人群MS的保护基因, HLA-DRB1*08:01在日本人群MS患者与正常对照之间差异无统计学意义, 对HLA-DRB1*04:05和纬度对日本人群MS疾病严重程度的影响研究发现:HLA-DRB1*04:05可以减少MS患者大脑损伤情况和脑脊液Ig G的异常程度, 而高纬度与HLA-DRBI*0405有着相反的作用。Andlauer等[37]发现DRB1*15:01、DRB1*13:03、DRB1*03:01、DRB1*08:01、DPB1*03:01是德国人群MS的风险基因, A*02:01、B*38:01是德国人群MS的保护性基因。
3 小结与展望
综上所述, 自身免疫病是一类涉及遗传和环境的复杂疾病, 从遗传角度HLA基因与自身免疫病的发生具有显着的相关性, HLA基因通过影响基因表达水平最后导致个体发生自身免疫病, 因此个体的HLA分型对于诊断和治疗某种自身免疫病有着重要的意义。目前自身免疫病相关的HLA主要为经典HLAⅡ类基因, 部分HLAⅠ类基因区也有所涉及, 尤其以HLA-G基因与自身免疫病的相关性研究的最多。随着高通量测序的应用, 人们发现一个自身免疫病可能与多个HLA位点有关, 一个HLA位点可能参与多个自身免疫病的发生, 因此寻找自身免疫病特异的HLA位点以及各个自身免疫病共有的风险基因显得尤为重要, 这将对自身免疫病的发病机制、早期诊断和特异性治疗提供理论依据。
参考文献:
[1] Patel B, Wi CI, Hasassri ME, et al.Heterogeneity of asthma and the risk of celiac disease in children[J].Allergy Asthma Proc, 2018, 39 (1) :51-58.
[2] Philip Deitiker, Zouhair Atassi.MHC genes linked to autoimmune disease[J].Crit Rev Immunol, 2015, 35 (3) :203-252.
[3] Piancatelli D, Barhdadi IBE, Oumhani K, et al.HLA typing and celiac disease in moroccans[J].Med Sci (Basel) , 2017, 5 (1) :2-2.
[4] Senapati S, Sood A, Midha V, et al.Shared and unique common genetic determinants between pediatric and adult celiac disease[J].BMC Med Genomics, 2016, 9 (1) :44-44.
[5] BibbS, Pes GM, Usai-Satta P, et al.Chronic autoimmune disorders are increased in celiac disease:A case-control study[J].Medicine (Baltimore) , 2017, 96 (47) :e8562.
[6]徐丹萍, 林爱芬, 颜卫华.HLA-G与自身免疫病相关性研究进展[J].生命科学, 2012, 24 (3) :217-222.Xu DP, Lin AF, Yan WH.The relationship between HLA-G and autoimmune diseases[J].Chn Bullt Life Sci, 2012, 24 (3) :217-222.
[7]Mitsdoerffer M, Schreiner B, Kieseier BC, et al.Monocyte-derived HLA-G acts as a strong inhibitor of autologous CD4 T cell activation and is upregulated by interferon-in beta vitro and in vivo:rationale for the therapy of multiple sclerosis[J].J Neuroimmunol, 2005, 159 (1-2) :155-164.
[8]Rizzo R, Hviid TV, Govoni M, et al.HLA-G genotype and HLA-Gexpression in systemic lupus erythematosus:HLA-G as a putative susceptibility gene in systemic lupus erythematosus[J].Tissue Antigens, 2008, 71 (6) :520-529.
[9] Langefeld CD, Ainsworth HC, Cunninghame Graham DSC, et al.Transancestral mapping and genetic load in systemic lupus erythematosus[J].Nat Commun, 2017, 8:16021.
[10] Fernando MMA, Jan F, Annette L, et al.Transancestral mapping of the MHC region in systemic lupus erythematosus identifies new independent and interacting loci at MSH5, HLA-DPB1 and HLA-G[J].Ann Rheum Dis, 2012, 71 (5) :777-784.
[11]Bettencourt A, Carvalho C, Leal B, et al.The protective role of HLA-DRB1*13 in autoimmune disease[J].J Immunol Res, 2015, 2015 (1) :948723.
[12] Van DV, Holoshitz J.A reciprocal HLA-disease association in rheumatoid arthritis and pemphigus vulgaris[J].Front Biosci (Landmark Ed) , 2017, 22:909-919.
[13] Viatte S, Barton A.Genetics of rheumatoid arthritis susceptibility, severity, and treatment response[J].Semin Immunopathol, 2017, 39 (4) :395-408.
[14]陈佳喜, 沈波.HLA-G与类风湿性关节炎相关关系的研究进展与趋势[J].医学研究杂志, 2012, 41 (1) :169-172.Chen JX, Shen B.Research progress and trends of the relationship between HLA-G and rheumatoid arthritis[J].J Med Res, 2012, 41 (1) :169-172.
[15]李长红, 魏琴, 李坤, 等.人类白细胞抗原G14bp插入/缺失多态性和风湿性疾病自身抗体产生的相关性研究[J].山西医药杂志, 2017, 46 (23) :2845-2848.Li CH, Wei Q, Li K, et al.Association of HLA-G 14bp insertion/deletion polymorphism with autoantibody production in patients with rheumatoid diseases[J].Shanxi Med J, 2017, 46 (23) :2845-2848
[16] Tokunaga K.Lessons from genome-wide search for disease-related genes with special reference to HLA-disease associations[J].Genes (Basel) , 2014, 5 (1) :84-96.
[17] Trier N, Izarzugaza J, Chailyan A, et al.Human MHC-II with shared epitope motifs are optimal epstein-barr virus glycoprotein42 ligands-relation to rheumatoid arthritis[J].Int J Mol Sci, 2018, 19 (1) :317-317.
[18] Achour Y, Ben HM, Chaabane S, et al.Analysis of two susceptibility SNPs in HLA region and evidence of interaction between rs64576175 on Tunisian rheumatoid arthritis[J].J Genet, 2017:911-918.
[19] Li Z, Brown MA.Progress of genome-wide association studies of ankylosing spondylitis[J].Clin Transl Immunol, 2017, 6 (12) :e163.
[20] Sheehan NJ.HLA-B27:whats new?[J].Rheumatology, 2010, 49 (4) :621-631.
[21] Taurog JD.The mystery of HLA-B27:If it isnt one thing, its another[J].Arthritis Rheum, 2007, 56 (8) :2478-2481.
[22]Brown M, Bunce M, Calin A, et al.HLA-B associations of HLA-B27 negative ankylosing spondylitis:comment on the article by Yamaguchi et al[J].Arthritis Rheum, 2014, 39 (10) :1768-1769.
[23] Wei JC, Tsai WC, Lin HS, et al.HLA-B60 and B61 are strongly associated with ankylosing spondylitis in HLA-B27-negative Taiwan Chinese patients[J].Rheumatology (Oxford) , 2004, 43 (7) :839-842.
[24] Yamaguchi A, Tsuchiya N, Mitsui H, et al.Association of HLA-B39 with HLA-B27-negative ankylosing spondylitis and pauciarticular juvenile rheumatoid arthritis in Japanese patients.Evidence for a role of the peptide-anchoring B pocket[J].Arthritis Rheum, 1995, 38 (11) :1672-1677.
[25] Cortes A, Pulit SL, Leo PJ, et al.Major histocompatibility complex associations of ankylosing spondylitis are complex and involve further epistasis with ERAP1[J].Nat Commun, 2015, 21;6:7146-7146.
[26]姜芳, 许敏.强直性脊柱炎患者基质金属蛋白酶和人白细胞抗原B27的表达分析[J].现代医药卫生, 2017, 33 (24) :3741-3744.Jiang F, Xu M.Analysis on expression of matrix metalloproteinases and HLA-B27 in patients with ankylosing spondylitis[J].JMod Med Health, 2017, 33 (24) :3741-3744.
[27]代东发, 孙玉英.HLA-B27分子及其与强直性脊柱炎关联的研究进展[J].生物技术通讯, 2014, 25 (1) :118-121.Dai DF, Sun YY.Research progress of HLA-B27 and its associate with ankylosing spondylitis[J].Letters Biotechnology, 2014, 25 (1) :118-121.
[28]李苗, 孙迪, 付冰冰, 等.肠道菌群与自身免疫性疾病研究进展[J].中国微生态学杂志, 2015, 27 (10) :1233-1237.Li M, Sun D, Fu BB, et al.Research on gut microbiota and autoimmune disease:progress review[J].Chin J Microecol, 2015, 27 (10) :1233-1237.
[29] Wang C M, Wang S H, Jan Wu Y J, et al.Human Leukocyte Antigen C*12:02:02 and Killer Immunoglobulin-Like Receptor2DL5 are Distinctly Associated with Ankylosing Spondylitis in the Taiwanese[J].Int J Mol Sci, 2017, 18 (8) :1775-1775.
[30] Parkkola A, Laine A P, Karhunen M, et al.HLA and non-HLAgenes and familial predisposition to autoimmune diseases in families with a child affected by type 1 diabetes[J].Plos One, 2017, 12 (11) :e0188402.
[31]杨丽, 刘金慧, 韩蓓, 等.妊娠期糖尿病胰岛自身抗体阳性与HLA-DRB1基因型相关探析[J].糖尿病新世界, 2016, 19 (22) :1-2.Yang L, Liu JH, Han B, et al.Analysis of correlation between the diabetes islet antoantibody positive in the gestation period and HLA-DRB1 genotype[J].Diabetes New World, 2016, 19 (22) :1-2.
[32] Reinauer C, Rosenbauer J, Bchle C, et al.The clinical course of patients with preschool manifestation of type 1 diabetes is independent of the HLA DR-DQ genotype[J].Genes (Basel) , 2017, 8 (5) :146-146.
[33] Fagbemi K A, Tcm M, Azonbakin S, et al.HLA class II allele, haplotype, and genotype associations with type 1 diabetes in benin:a pilot study[J].J Diabetes Res, 2017, 2017 (6) :1-4.
[34] Shahbazi M, Jsa A, Roshandel D, et al.Combination of interleukin-10 gene promoter polymorphisms with HLA-DRB1*15 allele is associated with multiple sclerosis[J].Indian J Med Res, 2017, 145 (6) :746-752.
[35] Moutsianas L, Jostins L, Beecham A H, et al.Class II HLA interactions modulate genetic risk for multiple sclerosis[J].Nat Genet, 2015, 47 (10) :1107-1113.
[36] Nakamura Y, Matsushita T, Sato S, et al.Latitude and HLA-DRB1*04:05 independently influence disease severity in Japanese multiple sclerosis:a cross-sectional study[J].J Neuroinflammation, 2016, 13 (1) :239-239.
[37] Andlauer TFM, Dorothea B, Gisela A, et al.Novel multiple sclerosis susceptibility loci implicated in epigenetic regulation[J].Sci Adv, 2016, 2 (6) :e1501678.
